El formaldehído es un compuesto químico simple hecho de hidrógeno, oxígeno y carbono. CH2O.
Todas las formas de vida – bacterias, plantas, peces, animales y seres humanos – producen naturalmente formaldehído como parte del metabolismo celular. El formaldehído también se produce en el cuerpo humano como parte de las funciones normales para construir los materiales básicos necesarios para los procesos importantes de la vida. Los estudios muestran que el formaldehído no se acumula en personas o animales porque se descompone rápidamente por los procesos metabólicos naturales del cuerpo. En el medio ambiente, el formaldehído se descompone rápidamente en el aire por la humedad y la luz solar, o por las bacterias en el suelo o el agua. Los usos del formaldehído están efectivamente regulados, y la supervisión del gobierno ha sido extensa. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha revisado la seguridad del formaldehído y ha aprobado su uso como aditivo alimentario indirecto en una serie de materiales que tienen contacto con los alimentos. La Administración de Seguridad y Salud Ocupacional (OSHA) tiene normas para la exposición en el lugar de trabajo al formaldehído que proporcionan una protección integral a los empleados a través de la implementación de buenas prácticas de higiene industrial.
Datos sobre el formaldehído:
– El formaldehído es un compuesto químico simple hecho de hidrógeno, oxígeno y carbono. Fórmula molecular: CH2O o HO(CH2 O)x H o H2CO o HCHO
– El formaldehído es un gas venenoso incoloro sintetizado por la oxidación del metanol y utilizado como antiséptico, desinfectante, fijador histológico y reactivo químico de uso general para aplicaciones de laboratorio.
– El formaldehído es fácilmente soluble en agua y se distribuye como una solución de 37 a 50, más comercialmente (37-40) % en formalina de agua. Cuando se calienta se genera el vapor de formaldehído.
– El formaldehído es un gas inflamable de olor fuerte. Debe manipularse con precaución cuando se utilice como desinfectante porque cuando las personas tienen una exposición a aire con concentraciones de formaldehído, a corto plazo, causa irritación de la piel, ojos, nariz, mucosas y garganta.
Riesgo de contaminación en huevos de incubación:
Las buenas prácticas de limpieza y desinfección son ampliamente reconocidas como parte de la optimización de la producción viable de pollitos de un día de edad en una incubadora. Una buena higiene del huevo ha demostrado a menudo mejorar la viabilidad y la calidad de los pollitos. El efecto de la penetración bacteriana a través de la cáscara de huevo afectará la calidad del nacimiento, como la mortalidad embrionaria temprana, la infección del huevo y el saco vitelino, la mortalidad de pollitos antes de la eclosión, además de una mortalidad significativamente mayor y la heterogeneidad de los pollitos durante la primera semana de edad. Obviamente, son varios los microorganismos que pueden contaminar los huevos de incubación a través de la contaminación vertical y/u horizontal (tales como, Salmonella sp., Mycoplasma sp., E.coli, Pseudomonas, Staphylococcus, Proteus sp. y Aspergillus fumigatus).
Una fuente importante de contaminación dentro de la incubadora es el mal estado sanitario de los huevos fértiles a su llegada a la Planta de Incubación. El nivel de limpieza de la incubadora, por lo tanto, depende en gran medida de las normas higiénicas de los lotes de reproductores, y en particular, de la recogida frecuente de huevos, el transporte de camiones de huevos desde la granja hasta la planta, la limpieza, calidad y control de piensos, agua, equipos de recogida de huevos dentro de la granja-nido, cama, alimentación, agua, polvo, circulaciones de aire, empleados, insectos, ratones, etc. En cada Planta de Incubación, debe ser obligatorio que sólo se establezcan huevos limpios. Estos huevos deben mantenerse limpios y lejos de las fuentes de contaminación en la granja, tan pronto como sea posible después de la recolección, para permitir la destrucción de microorganismos antes que estos tengan tiempo de penetrar a través de la cáscara de huevo.
Medidas de higiene durante la manipulación de huevos y pollitos de un día de edad (fuente: OIE / OMS):
- Los manipuladores de huevos en la Planta de Incubación deben lavarse las manos con agua y jabón, cambiar de ropas exteriores a limpias antes de manipular los huevos fértiles recibidos de la granja avícola.
- Los sexadores y manipuladores de pollitos deben lavarse y desinfectar sus manos, cambiarse a ropa y botas protectoras limpias antes de comenzar a trabajar y entre diferentes lotes de pollitos.
- Los pollitos de un día u otras aves de corral deben entregarse o distribuirse en cajas de pollitos nuevos; o en cajas de material adecuado que hayan sido limpiadas y desinfectadas o fumigados a fondo.
- Los pollitos deben ser entregados directamente de la incubadora por personal que lleve ropa exterior limpia y desinfectada. La ropa exterior debe cambiarse o desinfectarse entre cada entrega.
- El camión de entrega debe limpiarse y desinfectarse antes de cargar cada envío de pollitos.
Recomendaciones aplicables a la higiene y el transporte de huevos en incubación (fuente: OIE / OMS):
- La cama del galpón debe mantenerse seca y en buen estado. La arena y/o cama del nido debe estar limpia y en cantidad adecuada.
- Los huevos deben recogerse a intervalos frecuentes de no menos de dos veces al día y colocarse en recipientes limpios y desinfectados.
- Los huevos sucios, rotos, agrietados y con fisura deben recogerse en una bandeja separada y no deben utilizarse con fines de incubación.
- Los huevos limpios deben desinfectarse lo antes posible después de la recolección.
- Los huevos desinfectados deben almacenarse en una habitación limpia, libre de polvo, utilizada exclusivamente para este fin y mantenida a temperatura baja, siempre inferior a 20oC y con humedad relativa de 70-80%.
- Los huevos deberán transportarse a la incubadora en bandejas nuevas o limpias que hayan sido fumigadas o desinfectadas con un desinfectante líquido. La limpieza y desinfección de los vehículos debe ser una parte regular de la rutina de incubación.
Fumigación de huevos con formaldehído:
Formaldehído es ampliamente utilizado en plantas de incubación como el desinfectante más eficaz, que previene y mata la mayoría de los microorganismos que vienen con los huevos fértiles u otros objetos, aunque su uso está prohibido en algunos países, y algunas empresas buscan una desinfección alternativa en lugar de usarlo, pero hasta ahora no pueden proporcionar este resultado deseado, debido al alto poder del formaldehído para matar los patógenos con un bajo costo financiero.
Los requisitos para maximizar la actividad germicida a partir del formaldehído: 1) Temperatura: el rango de temperatura de 21-25oC. 2) Humedad: 60-80 %. 3) Tiempo de exposición: el tiempo necesario para matar los microorganismos depende de la temperatura, la humedad y la concentración de formaldehído, en su mayoría tardan 20 minutos. 4) La concentración de formaldehído, tamaño de la cámara de fumigación o sala por metro cúbico (PxAxL) 5) Circulación de gas: cómo distribuir gas eventualmente alrededor de la cáscara de huevo. 6) La cantidad de materia orgánica en la superficie de la cáscara. 7) Método utilizado para generar vapores de formaldehído: Tres métodos básicos que utilizan formalina líquida solo, añadiendo permanganato de potasio a la formalina líquida y polvo de paraformaldehído, de la siguiente manera:
– La volatilización del paraformaldehído polimérico a temperatura controlada. En promedio 60oC; Calefacción 91 por ciento de paraformaldehído a una velocidad de 5-10 gramos por metro cúbico de espacio en un evaporador eléctrico. De 10 a 20 minutos.
– Otra forma común utilizada en la industria avícola fue la adición de formalina liquida a per manganato de potasio (KMnO4) en proporción 2:1 (v/w). Añadiendo 35 ml de formalina (40 por ciento de formaldehído) a 17,5 g de permanganato de potasio «KMNO4» por metro cúbico de espacio durante 20 minutos. Cuando mezcle con permanganato de potasio para fumigación, siempre agregue la formalina al permanganato de potasio, nunca al revés. El formaldehído a concentraciones bactericidas es muy irritante para los ojos, la nariz y la garganta. El personal de la Planta de Incubación debe usar un respirador y evitar la exposición innecesaria al gas. Se debe utilizar un recipiente adecuado para liberar el gas. Los lados del contenedor deben inclinarse hacia afuera para evitar una acumulación excesiva de calor, que podría encender el formaldehído. El recipiente debe estar hecho de material a prueba de calor, como metal o barro, y debe ser lo suficientemente grande para evitar que los productos químicos hiervan.
– Formalina líquida 45-60 ml/ metro cúbico podría utilizarse en el evaporador eléctrico para diferentes habitaciones dentro de la incubadora o dentro de los vapores normales de incubadoras. Además, algunos añaden agua a la formalina para tener dilución al 5% y rociar a diferentes objetos en una incubadora.
Neutralización del gas formaldehído; El gas formaldehído puede ser neutralizado en 10-15 min utilizando hidróxido de amonio en una cantidad igual a la mitad del volumen de formalina utilizada.
Peligros de fumigación: Los riesgos para la salud humana de la fumigación del formaldehído son motivo de gran preocupación. El uso de formaldehído está prohibido en algunos países. Se debe evitar la exposición humana, y el uso de las máscaras de gas y la ropa protectora son esenciales.
Comparación de la desinfección del huevo de Formadehído y alternativas: (Revisión)
En el estudio de W.L.dosS.Cliranco et.al.2018 para evaluar el efecto de diferentes procedimientos de desinfección como alternativas a la fumigación de formaldehído en la carga microbiana de cáscara de huevo y la calidad de los huevos; los resultados mostraron que, los recuentos de bacterias mesofílicas aeróbicas totales y Enterobacteriaceae antes y después de la desinfección de cáscaras de huevos de engorde mostrados en la Tabla 1 a continuación, se puede señalar claramente que, el Formaldehído utilizó 13,3 gramos / 1 metro cúbico, fue tener los recuentos más bajos de bacterias después de los antidepresivos en comparación con otros desinfectantes alternativos utilizados en sus experimentos.
Tabla 1. Recuentos de bacterias mesofílicas aeróbicas totales y Enterobacteriaceae antes y después de la desinfección de cáscaras de huevos de un lote de pollos de engorde Cobb de 42 semanas de edad, utilizando los tratamientos de formaldehído, ozono, luz ultravioleta, peróxido de hidrógeno, ácido peracético, control húmedo (pulverización de agua) y control en seco (sin desinfección), seguido de las respectivas desviaciones estándar (SD).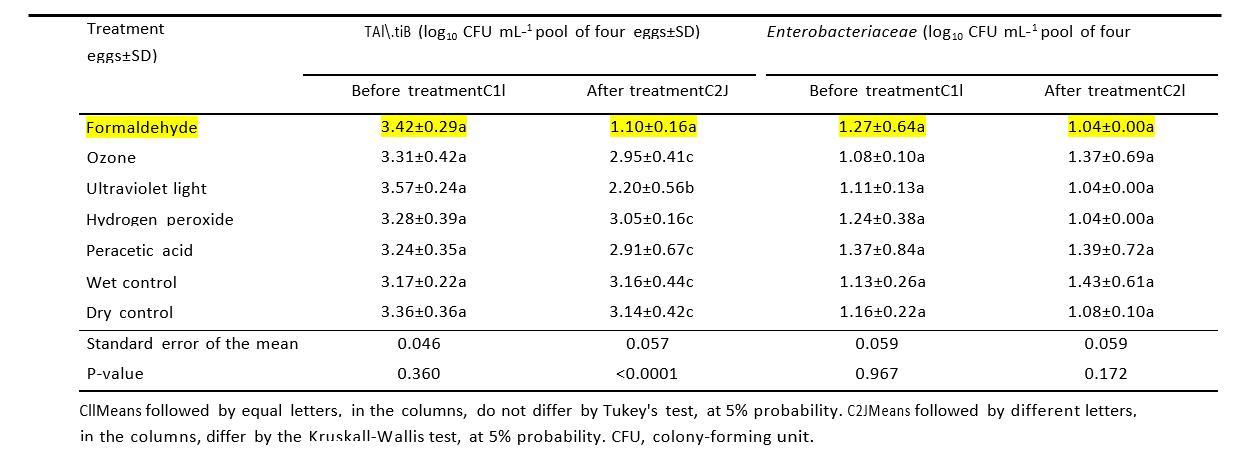
Mientras que otros estudios de Melo et.al.2019 utilizaron formaldehído de diferente concentración (5,03 g/m3 /30 min) que, W.L.dosS.Cliranco et.al.2018 concluyó que, debido a su efecto bactericida significativo en la cáscara de huevo, y la ausencia de efectos negativos sobre la calidad de la cáscara de huevo y los parámetros de incubación, UV-C y PAA están indicados como alternativas eficaces para la desinfectación de huevos de incubación en lotes adultos de reproductores pollos de engorde.
Introducir una alta concentración hasta la fumigación por formaldehído afectará negativamente, el Epitelio Traqueal de Embriones de Pollo y Polluelos como investigado por Hayretda y Kolankaya; (2008), se utilizaron métodos de fumigación de formaldehído se aplicó a embriones de 18 días de edad y pollitos de 1 día de edad sólo una vez, a 1 de 2 concentraciones diferentes (3x, 42 ml de formalina y 21 g de permanganato de potasio por m3 y 4x, 56 ml de formalina y 28 g de permanganato de potasio por m3) para 1 de 2 duraciones diferentes (20 min y 40 min). Se concluye que las células epiteliales traqueales fueron examinadas con Microscopía Electrónica de Transmisión (MET). Según MET, después de la fumigación los cilios en las células epiteliales fueron más cortos y menos en número, y la vacuolización, hinchazón de las mitocondrias, y el deterioro de cresta se observaron en los sujetos, que variaba según la concentración de fumigación y duración.
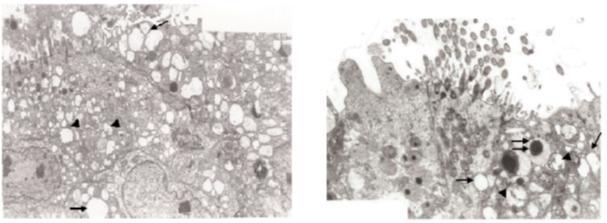 Figura (1) Figura (2)
Figura (1) Figura (2)
Hinchazón de las mitocondrias, el deterioro de las crestas (cabeza de flecha) y la vacuolización (flecha) en las células epiteliales traqueales de un embrión de 18 días de edad expuesto a la fumigación de 4 x durante 40 min (Figura 1), Vacuolización (flecha), defectos mitocondriales (punta de flecha) y lisosomas (flecha doble) en las células epiteliales traqueales de un embrión de 1 día de edad expuesto a la fumigación de 4x durante 40 min (Figura 2).
Finalmente, los autores resumieron que, según la investigación de MET, el acortamiento y la pérdida de cilios en las células epiteliales, la vacuolización, la hinchazón de las mitocondrias y el deterioro de sus crestas estaban presentes tanto en embriones de 18 días de edad como en polluelos de 1 día de edad. La ampliación del período de fumigación causó aumentos en estos efectos. Un factor importante en el efecto del formaldehído en la mucosa traqueal es la disolución del gas en las secreciones. El formaldehído disuelto en las secreciones mucosas provoca un cambio de pH hacia la acidez y estos cambios en el pH causan daño a la estructura de la membrana y a la actividad ciliar. Este estudio también muestra que la alteración líquida e iónica puede causar daño mitocondrial y vacuolización en las células epiteliales.
Badran A.M.M et.al 2018 estudió para investigar el efecto de algunos desinfectantes químicos diferentes de huevo (Formaldehído, Peróxido de hidrógeno H2O2 y TH4) contra las bacterias y para estudiar su efecto sobre la mortalidad embrionaria, la incubabilidad y algunos parámetros bioquímicos sanguíneos. (formaldehído, obtenido a partir de 60 ml de formalina, 30 ml de agua y 48 g de permanganato de potasio a una temperatura de 37oC, humedad del aire 80% y tiempo de exposición 30 minutos) conducción en efecto de desinfectantes en parámetro de incubabilidad fue positiva en comparación con H2O2 y TH4 como se muestra en las tablas 2, 3 a continuación:
Tabla 2: Efectos de algunos desinfectantes en las muertes embrionarias.
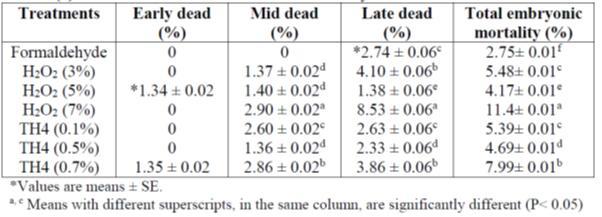
Tabla 3: Efectos de algunos desinfectantes en los rasgos de fertilidad y incubabilidad
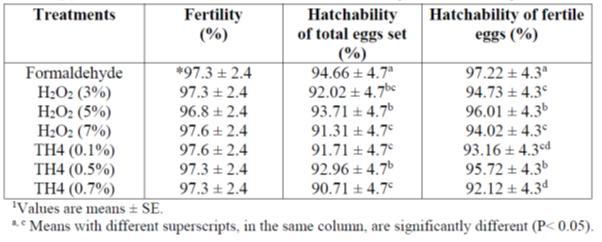
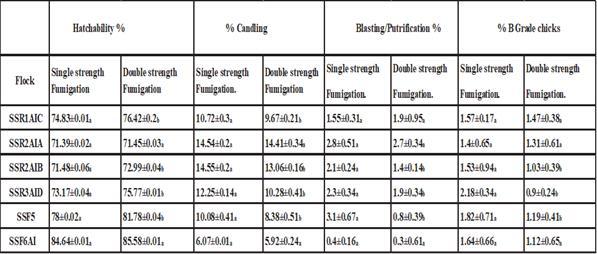
Aunque el Formaldehído tenía los mejores rasgos de incubabilidad % se podía notar de las tablas superiores, pero los parámetros de sangre era menor en comparación con H2O2 y TH4. Adnan. J. et.al (2019) estudió el uso de la fumigación de doble resistencia con gas formaldehído en la incubabilidad de huevos de reproductores de pollos de engorde, trasluz, explosión/putrefacción, muerte en cáscara, calidad de los pollitos y mortalidad posterior. La fumigación de ambos grupos se realizó mediante el sistema de fumigación automática proporcionado por chick master. Los huevos del grupo A fueron fumigados con 20 gramos de formalina KMNO4 de 40 ml (40% acuoso) a lo largo de 40 ml de agua durante 100ft3 durante 20 minutos según la fórmula L*W *H*20/100ft3 (para una sola fuerza), mientras que los huevos del grupo B fueron fumigados L*W*H*40/100ft3 (doble fuerza) durante 20 minutos. Después de la fumigación ambos grupos fueron inmediatamente desplazados a la incubación. (1 m3 a 35.3146667 ft3).
Los resultados mostrados en el Cuadro (4), los autores concluyeron que, la fumigación de ambos grupos se realizaba a través del sistema automático de fumigación proporcionado por el chick master. La incubabilidad y el manejo de lotes SSR1AIC, SSR2AIB, SSR3AID y SSF5 fueron significativamente <0.05 mejores para la fumigación de doble resistencia en comparación con la fumigación de fuerza única. Los muertos en cáscara eran insignificantes para el tratamiento. La putrefacción/explosiones y los pollitos de baja calidad fueron significativamente <0.05 mejores para la fumigación de doble resistencia para SSR2AIB, SSR3AID y SSF5, mientras que los lotes restantes eran insignificantes con respecto a la calidad de los pollitos y la putrefacción debido a la fuerza de fumigación. Los pollitos cada uno (n.o 30.000) fueron trasladados a las granjas de aves de corral de ambos grupos para conocer los efectos de la fuerza de fumigación en la vida posterior de los pollitos. El aumento de peso, la ingesta de piensos y la conversión alimenticia fueron insignificantes para ambos grupos, mientras que la mortalidad fue significativamente mejor para la fumigación de doble resistencia en comparación con la fumigación de fuerza única. En resumen, la fumigación de doble resistencia es segura se puede utilizar para mejorar los parámetros de la incubación y la vida posterior de los pollitos.
Tabla 4: El efecto de la fuerza de fumigación en la incubabilidad, la revisión a trasluz y la explosión/putrefacción y los pollitos de grado B a-b denotan diferencia en las filas (p<0.05)
Russell (1976) indicó que el formaldehído actúa sobre proteínas y también sobre ácidos nucleicos. Es factible que el gas formaldehído difundido en el óvulo en una etapa temprana del desarrollo embrionario transferirá los átomos de nitrógeno de las bases de purina y pirimidina en el ADN y el ARN inhiben así su función. Esto, a su vez, puede bloquear el desarrollo embrionario en una etapa temprana, incluso antes de la incubación. La fumigación cerca del momento de la eclosión también puede resultar en la mortalidad de embriones. La razón es que el formaldehído es un gas peligroso que puede dañar las vías respiratorias y los pulmones, cuando se inhala.
Cadirci.S (2009) resumió en su examen que, para la desinfección contra las especies de Salmonella, los huevos limpios de nido deben ser fumigados antes de la incubación a temperatura ambiente (25oC) y la humedad ambiental durante al menos 20 minutos con una concentración mínima de 600 mg de gas formaldehído por m3 (es decir, 10 g de paraformaldehído o 45 ml de formalina al 40% y 30 g de KMnO4). La fumigación en estas condiciones mata el 99,8% de los microorganismos en la superficie de la cáscara y no está asociada con un aumento de la mortalidad embrionaria. La fumigación no debe realizarse durante los primeros 9 días de incubación. La fumigación en pipping puede dañar el sistema respiratorio de los pollitos y tener efectos adversos en la salud y el rendimiento de producción. Además, el formaldehído también es peligroso para la salud humana.
Paula Johnson, 2018 concluyó que, El uso de formaldehído ha demostrado ser extremadamente eficaz para una serie de usos, incluyendo la producción de ropa, fabricación de madera, fabricación cosmética, uso desinfectante general, desinfección de huevos de aves de corral, e incluso el uso en gabinetes de incubación durante el proceso de eclosión. Esta molécula es muy eficaz como desinfectante en la industria avícola en la reducción de la carga de microorganismos. Su papel en la reducción de los microorganismo patógeno, en la disminución del potencial de microorganismos patógenos u oportunistas que llegan al embrión, lo que resulta en una disminución de la incubabilidad y la muerte embrionaria, o infecciones neonatales que resultan en muertes tempranas después de la colocación. En ausencia de alternativas que sean rentables y eficaces para el costo, el formaldehído continuará.
Resumen y Recomendaciones:
Actualmente, el formaldehído es el desinfectante potente más común de la industria avícola, y desinfectar los huevos de incubación en incubadoras para prevenir las transmisiones de patógenos. Tiene una amplia eficacia para matar la mayoría de los microorganismos, patógenos y es de bajo costo. Hay varios métodos para generar formaldehído, el comúnmente utilizado es la adición de formalina al permanganato de potasio (KMnO4) en relación 2:1 (v/w), podría ser reemplazado recientemente por volatilización de formaldehído del paraformaldehído polímero bajo sistema de temperatura controlada.
Hay algunos factores de influencia de la eficiencia de la fumigación de formaldehído para maximizar la actividad germicida a partir de formaldehído, es decir, la temperatura, la humedad, el tiempo de exposición, la concentración de formaldehído, la circulación de gas, la cantidad de materia orgánica en la superficie de la cáscara y el método utilizado para generar vapores de formaldehído.
Los eventos de uso de fumigación de formaldehído a alta concentración o tiempo de exposición largo causan muertes embrionarias tempranas antes de la incubación y en etapas tardías de embriones se verán afectados negativamente, el Epitelio Traqueal de embriones y pollitos, los cilios en las células epiteliales eran más cortos y menos en número, y se observó vacuolización, hinchazón de las mitocondrias y deterioro de crestas en los sujetos, que variaban según la concentración y duración de la fumigación.
Para obtener los máximos beneficios del formaldehído para matar el 99,8 % de microorganismos, patógenos y efectos negativos descuidados en la cutícula de cáscara de huevo y mejorar la incubabilidad y producir pollitos sanos desarrollados bien en la granja con un porcentaje de baja mortalidad y una mejor Conversión Alimenticia, debe considerar la forma adecuada discutida en estos documentos. Las precauciones de uso de formaldehído deben tomar en la práctica adecuada para evitar cualquier peligro para la salud humana.
Las Plantas de Incubación deben tener una sala o cámara de fumigación especial para prevenir el peligro de formaldehído a los trabajadores y la producción de incubadoras. Tal habitación debe proporcionar algunos requisitos y condiciones como sigue:
- La cámara debe estar bien aislada.
- Proporcione una buena ventilación.
- Suficientes espacios entre los carros para una buena circulación de aire.
- Proporcione ventiladores de escape fuertes a la atmósfera después de la neutralización cuando sea necesario.
- Control de temperatura y humedad.
- Proporcione una fuente de calentamiento de paraformaldehído y/o tanque de metal adecuado cuando utilice el método de permanganato de potasio formalina.
- El material de construcción de la cámara no es capaz de absorber o mantener el gas formaldehído residual.
- Prefiere proporcionar control de automatización a la cámara de fumigación.
Otras Recomendaciones:
Después de incubar huevos fumigados, prefiere mantener los huevos dentro de la cámara unas horas para asegurarse de que no queda gas residual en la cáscara de huevo (Olor), ya que no afecta negativamente, la etapa muy temprana de los embriones.
Tecnología de Sala de Fumigación EmTech (EFRT siglas en inglés):
El sistema de incubación EmTech proporciona la tecnología más avanzada para fumigar huevos fértiles utilizando formaldehído en incubadoras, EmTech implementó la ciencia, técnica, recomendación y mejores prácticas mencionadas en este artículo, para su diseño de sala de fumigación.
La sala de fumigación construida con diferentes tamaños (A x Lx A) para ser de diseño relacionado con la capacidad de producción de incubadoras y las necesidades de los clientes, construidos con aislamiento PRI enclavamiento tipo sandwich de metal blanco, certificados antiincendios, antimicroorganismos, completamente aislado, con puertas de acero inoxidable que tienen cerraduras magnéticas (Ver Fotos1,2)
Foto:1 Foto:2


Esas puertas y paneles completamente aislados evitan fugas de gas formaldehído fuera de la habitación, para la salud del personal y mantener el ambiente de incubación seguro de formaldehído como (OSHA) recomendaciones. Además, el material utilizado no es capaz de absorber el gas formaldehído, o mantener cualquier gas residual después de la operación de fumigación de los huevos para no afectar negativamente muy temprano el desarrollo embrionario dentro de las incubadoras modernas.
La sala de fumigación tiene un sistema de ventilación que contiene compuerta de entrada de aire y conducto de ventilador de gas de escape y 6 ventiladores en el lado de la pared para gas formaldehído distribuido uniformemente alrededor de todos los huevos dentro de la sala de fumigación. (Véanse las fotos 3, 4 y Digrama1) Y control de presión de aire.
Foto 3 Foto 4


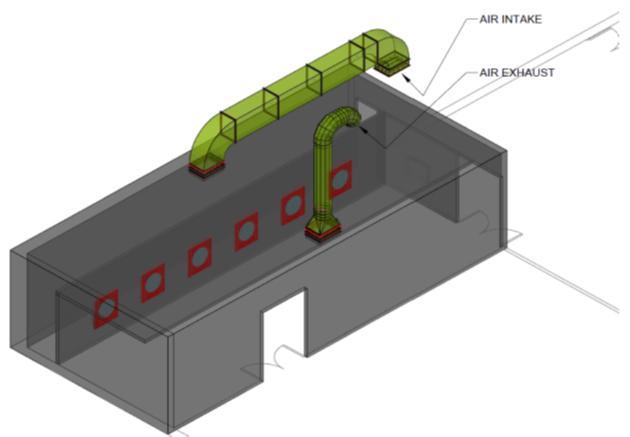
Diagrama 1
La sala de fumigación EmTech tiene control de pantalla frontal para controlar automáticamente todo el proceso de fumigación, temperatura, humedad, calentadores y temporizador, provisto también con calentador de sartén para el uso de paraformaldehído y bandejas-cacerola/s activa una segunda salida eléctrica para el calentador o sartenes que contienen una neutralización (ver diagrama 2). Además, el control de la sala de fumigación se puede operar de forma remota a través de la supervisión del sistema de incubación EmTech y la capacidad de guardar datos para cada operación de sala de fumigación para ayudar al equipo de gestión de incubadoras para una mayor investigación y asegurar el control estándar del proceso de la sala de fumigación.

Diagrama 2
El control de la sala de fumigación tiene comprobación manual/automática de cada opción antes de la ejecución de la fumigación, para garantizar que todas las funciones de la sala se ejecuten correctamente. Además, si sólo 1 opción falla el sistema no funcionará por la seguridad del ser humano y el medio ambiente fuera y dentro de la incubadora.
Hay muchas otras opciones para los usuarios de salas de fumigación, incluyendo el inicio de sesión de usuario, alarmas de valores bajos y altos de temperatura, humedad, velocidades de ventilador y presiones de aire, parada de emergencia como se describe en EmTech MANUAL DE USUARIO DE LA SALA DE FUMIGACIÓN.
Referencias:
Adnan JAbbAr, Adnan YousAf, Abdul HAmeed, AmJAd riaz, Yasir AllAH ditta., 2019: Influnces of Fumigation Strength on Hatchery Parameters and Later Life of Chicks. J Holistic Vet Sci Ani Care 1(1): 101.
Badran A.M.M; A. M. R. Osman and D. M.M. Yassein., 2018: COMPARATIVE STUDY OF THE EFFECT OF SOME DISINFECTANTS ON EMBRYONIC MORTALITY, HATCHABILITY, AND SOME BLOOD COMPONENTS. Egypt. Poult. Sci. Vol. (38)(IV): (1069-1081).
Cadirci S. (2009). Disinfection of hatching eggs by formaldehyde fumigation – a review. Arch Geflügelk 73. 2 S: 116-23.
Hayretda. S and Kolankaya D.,2008: Investigation of the Effects of Pre-Incubation Formaldehyde Fumigation on the Tracheal Epithelium of Chicken Embryos and Chicks. Turk. J. Vet. Anim. Sci. 32(4): 263-267
Melo E. F., W. L. S. Cl´ımaco, M. V. Triginelli, D. P. Vaz, M. R. de Souza, N. C. Bai˜ao, M. A. Pompeu, and L. J. C. Lara., 2019: An evaluation of alternative methods for sanitizing hatching eggs. Poult. Sci. 98:2466–2473.
RUSSELL, A.D., 1976: Inactivation of non-sporing bacteria by gases. Soc. Appl. Bacteriol. 5, 61-68.
Paula Johnson.,2018: Evaluation of the Effects of Formaldehyde on Growth Parameters of Broiler Chicks. Master theses; University of Arkansas, Fayetteville. http://scholarworks.uark.edu/etd.
- L. S. Cl´ımaco ., Melo E. F., M. V. Triginelli, D. P. Vaz, M. R. de Souza, N. C. Bai˜ao, M. A. Pompeu, and L. J. C. Lara., Mariana M. S., Maria F. V., Letícia C. F., Nelson C. B., Felipe M. de Souzaand.,2018: Eggshell microbiology and quality of hatching eggs subjected to different sanitizing procedures. Pesq. agropec. bras., Brasília, v.53, n.10, p.1177-1183.
https://pubchem.ncbi.nlm.nih.gov/compound/Formaldehyde
https://www.chemicalsafetyfacts.org/formaldehyde
https://www.epa.gov/indoor-air-quality-iaq
https://www.osha.gov/pls/oshaweb/owadisp.show_document?p_id=10075&p_table=STANDARDS


